La course à obstacles des nouveaux médicaments

Les nouveaux médicaments aident les gens à être plus en santé, plus longtemps, et à avoir des vies plus productives. Ils permettent aussi à nos systèmes de santé de réaliser des économies importantes. Cependant, le remboursement des nouveaux médicaments par les régimes publics canadiens peut faire l’objet de délais considérables, en raison d’un processus réglementaire très lourd. Loin de régler ce problème, une nouvelle réforme va dupliquer certaines étapes du processus et possiblement l’allonger.
Communiqué de presse : Nouveaux médicaments : les malades attendent inutilement 15 mois de trop
 En lien avec cette publication
En lien avec cette publication
 |
 |
 |
| Nouveaux médicaments : la longue marche réglementaire (Le Soleil, 5 avril 2018)
Innovative drugs need a new regulatory approach (The Globe and Mail, 10 avril 2018) |
Entrevue avec Mathieu Bédard (Québec aujourd’hui, BLVD 102.1 FM, 5 avril 2018)
Entrevue avec Mathieu Bédard (Isabelle, 98.5 FM, 5 avril 2018) Entrevue avec Mathieu Bédard (Boréale 138, Ici Radio-Canada, 10 avril 2018) |
Entrevue avec Mathieu Bédard (Mario Dumont, LCN-TV, 5 avril 2018) |
Ce Point a été préparé par Mathieu Bédard, économiste à l’IEDM. La Collection Santé de l’IEDM vise à examiner dans quelle mesure la liberté de choix et l’initiative privée permettent d’améliorer la qualité et l’efficacité des services de santé pour tous les patients.
Les nouveaux médicaments aident les gens à être plus en santé, plus longtemps, et à avoir des vies plus productives. Ils permettent aussi à nos systèmes de santé de réaliser des économies importantes. Les chiffres sont frappants : si, après 1995, les pays développés n’avaient eu accès à aucun nouveau médicament traitant les maladies cardiovasculaires, les séjours à l’hôpital pour ces maladies auraient coûté 70 % de plus dix ans plus tard(1).
Cependant, le remboursement des nouveaux médicaments par les régimes publics canadiens peut faire l’objet de délais considérables, en raison d’un processus réglementaire très lourd. Loin de régler ce problème, une nouvelle réforme va dupliquer certaines étapes du processus et possiblement l’allonger.
La longue marche réglementaire
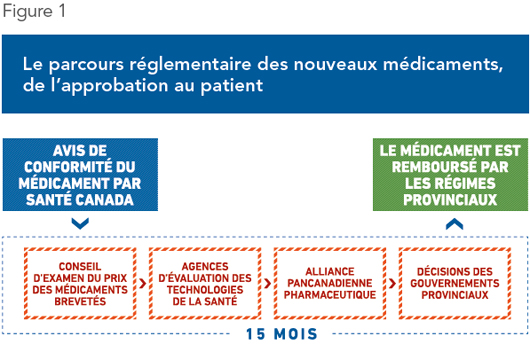
Santé Canada examine tous les nouveaux médicaments afin de s’assurer de leur innocuité, de leur efficacité et de leur qualité. Lorsque les tests sont concluants, elle approuve leur mise en marché(2). Un médicament approuvé pour la vente n’est toutefois pas automatiquement remboursé par les régimes provinciaux d’assurance médicaments.
Chaque nouveau médicament est aussi scruté par le Conseil d’examen du prix des médicaments brevetés (CEPMB), un organisme fédéral qui fait une évaluation économique dans le but de fixer un prix maximal, en fonction de l’innovation qu’apporte le médicament(3).
Ensuite, les agences d’évaluation des technologies de la santé examinent l’opportunité de rembourser le médicament, en fonction de la capacité de payer des gouvernements provinciaux(4). Une fois cette évaluation réalisée, les provinces négocient ensemble les prix avec le fabricant par l’entremise de l’Alliance pancanadienne pharmaceutique (APP). Cette seule étape peut prendre plusieurs mois(5). Toutes ces organisations se penchent sur le prix des médicaments, chacune à leur façon, même si aucune d’entre elles n’achète ou ne rembourse de médicaments.
Enfin, les gouvernements des provinces se servent de ces études et du résultat des négociations pour choisir quels médicaments ils incluront sur leurs listes respectives de médicaments remboursés.
En 2015-2016, le processus d’évaluation économique ajoutait en moyenne 450 jours, soit environ 15 mois, entre le moment où les médicaments sont approuvés par Santé Canada et celui où ils sont remboursés par les assureurs publics, et parfois beaucoup plus(6). Dans le cas récent d’un nouveau médicament pour le cancer du sein, l’approbation par Santé Canada en mars 2016 n’a donné lieu à une inscription sur la liste des médicaments remboursés par la Régie de l’assurance maladie du Québec (RAMQ) qu’en février 2018, soit 23 mois plus tard(7). La Figure 1 illustre ce parcours laborieux.
La récente réforme du CEPMB entend étendre son rôle. En plus de modifier ses méthodes de calcul des prix maximaux, l’organisation pourra dorénavant réaliser le même type d’analyse que les agences d’évaluation des technologies de la santé et dupliquer leur travail(8). On peut se questionner sur l’utilité d’alourdir le fardeau réglementaire quand on sait que les médicaments ne sont que très rarement vendus aux prix maximaux déterminés par cette agence(9).
De plus, cette complexification du processus d’évaluation des nouveaux médicaments va vraisemblablement affecter leur disponibilité. Les fabricants cherchent évidemment à recouvrer leurs coûts de recherche et de conformité réglementaire, et ainsi assurer le développement des prochaines générations de médicaments. Tout ce qui alourdit davantage ce processus ou augmente les coûts qui en découlent risque de les inciter à introduire d’abord leurs nouveaux médicaments sur des marchés moins contraignants et plus rentables que le Canada. C’est d’ailleurs déjà le cas à certains égards, puisque plusieurs nouveaux médicaments sont soumis à Santé Canada longtemps après l’avoir été aux autorités américaines et européennes, soit un délai additionnel de six mois(10).
En ajoutant ces nouvelles barrières réglementaires et en changeant les pays avec lesquels il se compare dans le but explicite de réduire les prix des nouveaux médicaments(11), Ottawa semble décidé à prouver coûte que coûte qu’au Canada, leur prix est en soi excessif, sans tenir compte des économies que ces médicaments permettent de réaliser à l’intérieur des systèmes de santé du pays.
Comment l’Allemagne réduit les délais
Cette course à obstacles que doivent affronter les nouveaux médicaments au Canada n’est pas une fatalité. En Allemagne, par exemple, les médicaments sont remboursés dès leur autorisation par les autorités sanitaires. Les évaluations économiques ne débutent qu’un an après leur mise en marché. Le gouvernement décide ensuite si le médicament doit continuer à être remboursé, et à quel prix(12).
Avant la réalisation de l’étude économique, mais aussi après, les dépenses en médicaments sont limitées par un budget alloué à chaque médecin en fonction de sa spécialité et des dépenses des années précédentes. Les prix des médicaments sont donc essentiellement gouvernés par le fait que les médecins prescriront moins d’un médicament si son prix est démesuré et s’il accapare une trop grande partie de leur budget(13).
Les hôpitaux allemands, eux, établissent eux-mêmes leurs listes de médicaments à prescrire, dès leur approbation. Ils choisissent les médicaments en fonction des budgets qui leur sont alloués pour chaque patient(14). Le système allemand montre donc comment la réglementation peut laisser une place importante aux principes d’économie de marché, que les systèmes canadiens tendent à remplacer par la bureaucratie.
Gagner 15 mois
Au lieu d’alourdir le fardeau réglementaire et de risquer de pénaliser les patients, Santé Canada devrait chercher à augmenter et accélérer l’accès en s’inspirant des meilleures pratiques, soit avoir recours à des prix résultant de l’offre et de la demande et autoriser le remboursement des nouveaux médicaments dès leur approbation. Un tel changement pourrait permettre aux Canadiens d’y avoir accès au moins 15 mois plus tôt, une éternité lorsqu’on est malade.
Références
1. Frank R. Lichtenberg, « Have Newer Cardiovascular Drugs Reduced Hospitalization? Evidence from Longitudinal Country-Level Data on 20 OECD Countries, 1995-2003 », Health Economics, vol. 18, no 5, 2009, p. 519-534.
2. À lui seul, ce processus peut prendre entre six mois et deux ans. Gouvernement du Canada, Comment les médicaments sont examinés au Canada; Yanick Labrie, « Quel rôle jouent les secteurs public et privé dans l’innovation pharmaceutique? », Note économique, IEDM, 3 septembre 2014.
3. Gouvernement du Canada, Conseil d’examen du prix des médicaments brevetés, Réglementation des prix, Processus réglementaire.
4. Au Québec, il s’agit de l’Institut national d’excellence en santé et en services sociaux (INESSS), et de l’Agence canadienne des médicaments et des technologies de la santé (ACMTS) dans le reste du Canada. Agence canadienne des médicaments et des technologies de la santé, À propos du Programme commun d’évaluation des médicaments de l’ACMTS (PCEM); Institut national d’excellence en santé et en services sociaux, Processus et critères d’évaluation.
5. Don Husereau et al., « Evolution of Drug Reimbursement in Canada: The Pan-Canadian Pharmaceutical Alliance for New Drugs », Value in Health, vol. 17, no 8, décembre 2014, p. 888-894.
6. Médicaments novateurs Canada, L’accès aux nouveaux médicaments dans les régimes publics d’assurance médicaments : au Canada et dans des pays comparables, Rapport annuel 2016, Graphique 6, p. 23.
7. Gouvernement du Canada, recherche sur les avis de conformité de Santé Canada, Numéro d’identification du médicament : 02453150; RAMQ, Liste des médicaments : dernière mise à jour le 1er février 2018. Les patients assurés par les régimes publics peuvent aussi tenter leur chance auprès du programme Patient d’exception de la RAMQ au Québec ou, le cas échéant, auprès de l’équivalent disponible dans certaines autres provinces. RAMQ, Pharmaciens, Médicaments, Le régime public d’assurance médicaments et les mesures des médicaments d’exception et du patient d’exception.
8. Les évaluations des technologies de la santé sont difficilement généralisables et transférables d’une agence à une autre. Une évaluation centrale, applicable à tous les Canadiens, comme celle que fait le CEPMB, ne pourra pas être utilisée par les autres agences qui font déjà ces mêmes calculs. M.J. Sculpher et al., « Generalisability in Economic Evaluation Studies in Healthcare: A Review and Case Studies », Health Technology Assessment, vol. 8, no 49, 2004, p. 1-192; Gazette du Canada, « Règlement modifiant le Règlement sur les médicaments brevetés: résumé de l’étude d’impact de la réglementation », vol. 151, no 48, 2 décembre 2017.
9. Don Husereau et al., op. cit., note 5, p. 889.
10. Il s’agit du délai médian, le délai moyen étant beaucoup plus long. Ali Shajarizadeh et Aidan Hollis, « Delays in the Submission of New Drugs in Canada », Canadian Medical Association Journal, vol. 187, no 1, 6 janvier 2015, p. E47-E51.
11. Mathieu Bédard et Patrick Déry, « Accès aux médicaments : un équilibre fragile à ne pas rompre », Point, IEDM, 15 novembre 2017.
12. IGES Institute, Reimbursement of Pharmaceuticals in Germany 2018, p. 13-14 ; Luc Nguyen-Kim et al., « Les politiques de prise en charge des médicaments en Allemagne, Angleterre et France », Questions d’économie de la santé, IRDES, no 99, octobre 2005, p. 3.
13. Luc Nguyen-Kim et al., idem.
14. Ces budgets sont établis par les autorités en fonction des maladies des patients et couvrent l’ensemble de leurs soins. Les autorités ne remboursent donc pas les médicaments directement, mais bien l’ensemble du traitement des patients. Les hôpitaux sont libres de gérer ces budgets comme il leur semble approprié. Ecker + Ecker, Reimbursement of Innovative Pharmaceuticals and Medical Devices in Germany, 2015, p. 13 ; IGES Institute, op. cit., note 12, p. 22.

